Universidad Tecnológica de
Santiago
(UTESA).
Nombres y matriculas:
Yosibel Pichardo
Rodriguez
1-12-2003.
Orange Pita
Marte
1-12-0815.
Mariela Familia
Polanco
2-12-1479.
Steffanie Genao 2-11-2125.
Candy Carolina Graveley Ferreira 2-11-1131.
Acedis Disla 2-12-0501
Grupo:
003.
Presentado a:
Mirtha Villar.
Tema:
INFLAMACION Y
FAGOCITOSIS.
Asignatura:
Inmunología.
Inflamación
Reacción celular de la respuesta innata. Consiste en
atracción de leucocitos y extravasación de proteínas plasmáticas hacia la zona
de infección para eliminar agente infecciosa.
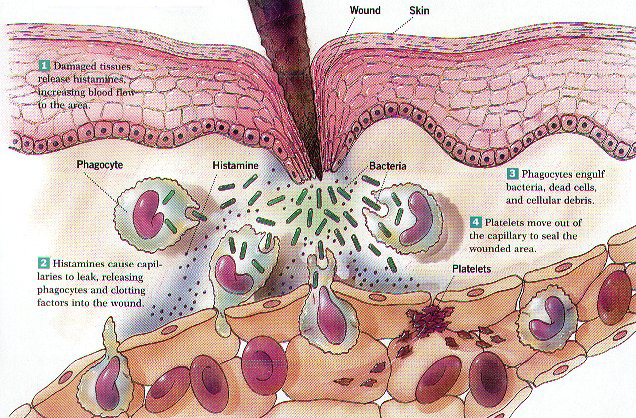
Cuando se produce una rotura de la piel o de las mucosas,
los microorganismos pueden pasar del medio externo al interno. Como reacción y
en un intento de localizar al agente invasor, se produce una reacción en el
tejido conectivo vascularizado que se denomina inflamación. Este complejo
proceso produce el acúmulo de fluidos y leucocitos en el espacio extravascular.
La inflamación puede ser originada por factores endógenos (necrosis tisular o
rotura ósea) o factores exógenos como lesiones por agentes mecánicos (corte,
etc), físicos (quemaduras), químicos (corrosivos), biológicos (microorganismos)
e inmunológicos (reacciones de hipersensibilidad). Aunque en algunos casos,
como la hipersensibilidad, la inflamación puede tener consecuencias nocivas,
por lo general es una respuesta protectora que trata de restaurar los tejidos
lesionados. Tras un proceso inflamatorio puede ocurrir lo siguiente:
• Resolución
con retorno a una estructura y función normales
• Supuración
con formación de absceso
• Hinchazón
con regeneración de tejido especializado o fibroso formando una cicatriz y
• Persistencia
del agente causante, haciéndose el proceso crónico
La respuesta inflamatoria está formada por plasma, células
circulantes, vasos sanguíneos y constituyentes celulares y extracelulares del
tejido conectivo. Entre las células circulantes se incluyen los neutrófilos,
monocitos, eosinófilos, linfocitos, basófilos y plaquetas. Las células del
tejido conectivo son los mastocitos, que rodean los vasos sanguíneos y los
fibroblastos. La matriz extracelular consiste en proteínas fibrosas
estructurales (colágeno, elastina), glicoproteínas adherentes (fibronectina,
laminina, entactina, tenascina y otras) y proteoglicanos. La membrana basal es
un componente especializado de la matriz extracelular que consiste en
glicoproteínas adhesivas y proteoglicanos.
Los cuatro signos cardinales de la inflamación fueron
descritos por Paracelso (30 AC al 38 DC) y son:
Rubor
(coloración roja)
Tumor
(hinchazón)
Calor
Dolor.
Posteriormente, Galeno (130-200) añadió un quinto signo:
pérdida de función. La coloración y el calor se deben a un aumento del flujo
sanguíneo en el área traumática y a la constricción de las vénulas. Los cambios
de la microcirculación son inducidos por mediadores químicos. Estos mediadores,
además, aumentan la permeabilidad capilar con lo que los líquidos y las células
sanguíneas pasan al espacio extravascular provocando la hinchazón y un aumento
de la presión local que es el que origina el dolor
TIPOS DE INFLAMACION
La inflamación según su duración se divide en aguda y
crónica. La aguda es de duración relativamente corta (minutos, horas o unos
pocos días), se inicia muy rápidamente y se caracteriza por el exudado de
fluidos plasmáticos y la migración de leucocitos predominantemente neutrófilos.
La inflamación crónica dura semanas, meses o incluso años y se caracteriza
histológicamente por el infiltrado de linfocitos y macrófagos con la
proliferación de vasos sanguíneos y tejido conectivo
Inflamación aguda
Los cambios que se producen tras la lesión tisular se deben
a tres procesos:
Cambios
en el flujo y calibre vascular, que hacen que aumente el flujo sanguíneo
Cambios
estructurales en los vasos sanguíneos que aumentan la permeabilidad vascular e
inducen la formación de exudado inflamatorio
Paso de
los leucocitos del espacio vascular al extravascular alcanzando así el foco de
las lesiones.
El resultado de todo
ello es el acúmulo de un fluido rico en proteínas, fibrina y leucocitos.
En los primeros 10-15 minutos se produce una hiperemia por
dilatación de arteriolas y vénulas y apertura de los vasos de pequeño calibre.
Tras esta fase aumenta la viscosidad de la sangre, lo que reduce la velocidad
del flujo sanguíneo. Al disminuir la presión hidrostática en los capilares, la
presión osmótica del plasma aumenta, y en consecuencia un líquido rico en
proteínas sale de los vasos sanguíneos originando el exudado inflamatorio.
Inflamación crónica
Si la inflamación dura semanas o meses se considera crónica,
y tiene dos características importantes:
El
infiltrado celular está compuesto sobre todo por macrófagos, linfocitos y
células plasmáticas
La
reacción inflamatoria es más productiva que exudativa, es decir, que la
formación de tejido fibroso prevalece sobre el exudado de líquidos.
La inflamación crónica puede producirse por diversas causas:
a) progresión de una inflamación aguda; b) episodios recurrentes de inflamación
aguda y c) inflamación crónica desde el comienzo asociada frecuentemente a
infecciones intracelulares (tuberculosis, lepra, etc).
Microscópicamente la inflamación crónica se caracteriza por
la presencia de macrófagos y sus derivados (células epitelioides y gigantes),
linfocitos, células plasmáticas, neutrófilos, eosinófilos y fibroblastos.
Inflamación crónica granulomatosa
Algunas formas de inflamación crónica tienen una histología
peculiar que consiste en el acúmulo de macrófagos modificados llamados
epitelioides formando unos agregados nodulares llamados granulomas. Las células
epitelioides reciben ese nombre porque se asemejan a células epiteliales.
Tienen un núcleo vesicular y abundante citoplasma eosinófilo y segregan el
enzima convertidor de angiotensina (Kininasa II), la fosfatasa ácida y
mucopolisacáridos. Además, los macrófagos pueden fusionarse por efecto del
IFN-g y formar células gigantes que contienen hasta 100 núcleos.
MECANISMOS QUE INTERVIENEN EN LA INFLAMACION
Migración leucocitaria
Inicialmente, en la inflamación aguda se acumulan
predominantemente los leucocitos neutrófilos polimorfonucleares y en las fases
tardías, los monocitos y macrófagos. Hay tres fases para el reclutamiento de
las células en la región dañada, es decir, la extravasación o salida de las
células desde la luz del vaso al espacio intersticial.
Normalmente las células ocupan la parte central del torrente
sanguíneo teniendo muy poco contacto con el endotelio. Al aumentar la
permeabilidad vascular, el flujo sanguíneo se enlentece, lo que permite a los
leucocitos acercarse al endotelio vascular. Este proceso se denomina marginación
y se debe a los cambios hemodinámicos producidos en la inflamación.
Los leucocitos escapan del torrente circulatorio mediante un
movimiento ameboide activo. Cuando los leucocitos entran en contacto con la
célula endotelial, proyectan pseudópodos y migran por la superficie hasta que
detectan una unión celular inter-endotelial. Durante su paso desde la luz
vascular al tejido extravascular, el leucocito rompe las uniones
inter-endoteliales y la membrana basal probablemente a través de la secreción
de colagenasa.
El tipo de leucocito que migra depende mucho del tiempo que
dura la inflamación y del tipo de estímulo. En la mayoría de los casos, en la
inflamación aguda los neutrófilos son las células predominantes durante las
primeras 24 horas. Estas células empiezan a acumularse en los primeros minutos
tras la lesión, mientras que los monocitos y macrófagos se acumulan más tarde,
tras 24 horas. Después de la extravasación, los leucocitos migran en los
tejidos a los lugares donde se ha producido la lesión mediante el proceso de
quimiotaxis.
Células que intervienen en la inflamación
En la inflamación intervienen multitud de células pero entre
ellas destacan los granulocitos neutrófilos y los fagocitos mononucleares. La
vida de los neutrófilos es muy corta, sólo de 3 a 4 días. Algunos de los
productos de los gránulos son bactericidas, mientras que otros son capaces de
degradar la matriz proteica extracelular Muchos de los neutrófilos mueren en
los lugares de inflamación liberando los enzimas que pueden dañar las células o
las proteínas de la matriz extracelular.
Los fagocitos mononucleares se diferencian en prácticamente
todos los tejidos del organismo de distinta manera según el tejido que ocupan,
dando lugar a macrófagos. Los macrófagos tienen una producción autocrina de
factores de crecimiento tales como el GM-CSF o el M-CSF que hacen que
proliferen localmente en los tejidos. Para llevar a cabo sus funciones, los
macrófagos necesitan ser activados por el IFN-g.
Moléculas que intervienen en la inflamación
Además de las células directamente implicadas en la
inflamación, como son los neutrófilos, macrófagos y linfocitos, los basófilos,
mastocitos, plaquetas y células endoteliales también producen mediadores
químicos, Hay dos tipos, los mediadores tisulares y los mediadores plasmáticos
de la inflamación.
Mediadores tisulares
de la inflamación
La activación de los mastocitos, basófilos y plaquetas
estimula el metabolismo del ácido araquidónico con la consiguiente síntesis de
prostaglandinas, leucotrienos y tromboxanos (Figura 25.3).
La histamina y la serotonina, segregadas por mastocitos,
basófilos y plaquetas, producen vasodilatación y aumentan la permeabilidad
vascular. El PAF es un complejo lisofosfolípido-acetilado que induce la
agregación plaquetaria y la degranulación. Además, aumenta la permeabilidad
vascular, induce la adhesión leucocitaria y estimula la síntesis de derivados
del ácido araquidónico. Estos derivados incluyen las prostaglandinas y los
leucotrienos.
El ácido araquidónico es un ácido graso derivado del ácido
linoleico que se encuentra en la membrana celular y bajo estimulación puede ser
liberado al exterior de la célula por una fosfolipasa(Figura 25.4). El óxido
nítrico se produce por las células endoteliales,
macrófagos y neuronas del cerebro.
Mediadores plasmáticos de la inflamación
El factor XII de la coagulación (Factor Hageman) se activa
por superficies extrañas cargadas negativamente, tales como la membrana basal,
enzimas proteolíticos o lipopolisacáridos. Una vez activado, el factor XII
puede activar el sistema de la coagulación, el de la fibrinolisis y el de las
kininas-kalicreína.
MANIFESTACIONES SISTEMICAS DE LA INFLAMACION
Las manifestaciones sistémicas se conocen de forma colectiva
como respuesta de la fase aguda. Al llegar un agente que produzca una lesión
hay un ajuste rápido en la composición de las proteínas plasmáticas y la
concentración de algunas aumenta, mientras que la de otras disminuye. Una de
las que aumenta es la proteina C reactiva, que funciona como opsonina de bacterias,
la a-2-macroglobulina y otras antiproteinasas, el fibrinógeno del sistema de la
coagulación y el amiloide sérico A, cuya función se desconoce. La albúmina y la
transferrina disminuyen. La mayoría de estos cambios se producen por
alteraciones en la síntesis de estas proteínas por los hepatocitos.
La inflamación produce fiebre a través de pirógenos externos
(endotoxina generalmente) que estimulan la producción de pirógenos endógenos
como la IL1 o el TNF. Estas citocinas actúan sobre el hipotálamo anterior,
donde se encuentra el termostato central del organismo e inducen la producción
de PGE2 que hace aumentar la temperatura corporal. Además, en la sangre
periférica se puede observar una leucocitosis, es decir, un aumento del número
de leucocitos (dos o tres veces). Este aumento se debe sobre todo a los
neutrófilos, entre los que aparecen algunas formas inmaduras (cayados).
REPARACION DE LA INFLAMACION
En la inflamación se produce una destrucción de las células
del parénquima y de las del estroma. El tejido lesionado se repara mediante
tejido conectivo que va a producir la fibrosis y la escarificación. En este
proceso intervienen los componentes siguientes:
Formación
de nuevos vasos sanguíneos (angiogénesis)
Migración
y proliferación de fibroblastos
Depósito
de matriz extracelular
Maduración
y organización del tejido fibroso (remodelación).
El proceso de reparación empieza a las 24 horas tras la
lesión. Los fibroblastos y las células del endotelio vascular comienzan a
proliferar formando el tejido de granulación en el cual se forman nuevos vasos
(angiogénesis).
La fagocitosis
La fagocitosis es un tipo de endocitosis por el cual algunas
células (fagocitos y protistas) rodean con su membrana citoplasmática
partículas sólidas y las introducen al interior celular. Esto se produce
gracias a la emisión de pseudópodos alrededor de la partícula o microorganismo
hasta englobarla completamente y formar alrededor de él una vesícula, llamada
fagosoma, la cual fusionan posteriormente con lisosomas para degradar el
antígeno fagocitado.
La fagocitosis es tanto un medio de defensa ante microorganismos
invasores como de eliminación (e incluso reciclaje) de tejidos muertos.
La fagocitosis es el proceso de captura de partículas en el
interior de una célula, ya sean bacterias, parásitos, células apoptóticas; en
definitiva, toda clase de partícula extraña. Involucra a varios procesos
moleculares. Se produce cuando estos elementos se unen a receptores de la
superficie del fagocito, cambiando su estructura tridimensional e induciendo la
inclusión de la partícula en el interior de la célula.
Los granulocitos neutrófilos y los monocitos (macrófagos) poseen
un origen común. Su antecesor ontogenético es la célula pruripotencial
mielo-monocítica (CFU-GM).
Polimorfonucleares neutrófilos
Constituyen más del 90%
de los granulocitos (polimorfonucleares)
Son de vida corta y se producen en la médula ósea alrededor de cien mil
millones al día. Su núcleo es
multilobulado (de 2 a 5 lóbulos) .
Posee gránulos citoplásmicos
de dos tipos: los azurófilos (primarios) y los específicos (secundarios). Tras salir de la médula ósea, circulan por la
sangre durante 7-10 horas, y luego pasan a tejidos, donde mueren a los 2-3
días.
Cuando
hay infección, la médula ósea produce más cantidad de neutrófilos (la
leucocitosis de neutrófilos es un indicio clínico de infección).Son los primeros
fagocitos en llegar a la zona de infección, atraídos por quimiotaxis.
Al llegar al foco, actúan
como fagocitos: ingieren la partícula extraña, incluyéndola en un fagosoma, al
que fusionan sus gránulos:
Gránulos azurófilos (primarios): son mayores y más densos, con
típica morfología de lisosoma. Contienen mieloperoxidasa y agentes
antimicrobianos no oxidantes.
Gránulos específicos (secundarios): son más pequeños y menos
densos a los electrones; contienen la mayor parte de la lisozima de la célula,
así como lactoferrina y fosfatasa alcalina.
Ambos tipos de gránulos se
fusionan con el fagosoma, para digerir y eliminar la partícula extraña, con
mecanismos dependientes de oxígeno más potentes que los del macrófago.
Fagocitos mononucleares
El sistema fagocítico mononuclear (SFM) está constituido por los
monocitos circulantes y los macrófagos tisulares. Los promonocitos de la médula
ósea, al madurar salen de ella, diferenciándose en monocitos circulantes, que
al cabo de 8 horas emigran a distintos tejidos, donde se convierten en
macrófagos.
Monocitos
· Son células de
unos 10-18 m de diámetro, con núcleo en forma de herradura o de pera.
· Microscópicamente
en su membrana aparece con finas rugosidades.
· Su citoplasma
posee gránulos azurófilos, que al microscopio electrónico son densos y
homogéneos. Dichos gránulos son lisosomas que contienen peroxidasa e hidrolasas
ácidas importantes para el mecanismo de muerte intracelular de microorganismos.
· El aparato de
Golgi está bien desarrollado, y se observan mitocondrias.
Macrófagos
Los macrófagos pueden ser residentes (fijos en tejidos) o libres.
Residentes: cumplen misiones concretas en cada uno de los tejidos,
pudiendo recibir, en su caso, denominaciones peculiares. Por ejemplo:
· Células de
Kupffer, en las paredes vasculares de las sinusoides hepáticas.
· Células
mesangiales de los glomérulos renales.
· Macrófagos
alveolares de los pulmones.
· Macrófagos de las
serosas de la cavidad peritoneal.
· Células de la
microglía del cerebro.
· Osteoclastos de
los huesos.
· Histiocitos del
tejido conjuntivo.
Libres: están
estratégicamente situados para atrapar material extraño en órganos linfoides
secundarios:
· Macrófagos de los
sinusoides esplénicos (en el bazo).
· Macrófagos de los
senos medulares (en los ganglios linfáticos).
Características principales:
· Los macrófagos son
células de vida más larga que los neutrófilos.
· Poseen un núcleo
en herradura.
· En su citoplasma
se ve un abundante retículo endoplásmico rugoso y gran número de mitocondrias.
· Están
especialmente adaptados a luchar contra virus, bacterias y protozoos
intracelulares.
Los fagocitos mononucleares constituyen el mejor ejemplo de
células que, siendo en principio del S.I. natural, en el curso de la evolución
se han adaptado a jugar papeles centrales en el S.I. adaptativo:
En la respuesta inmune
natural: los fagocitos presentan dos tipos de actividades:
· Como tales
fagocitos
· Como productores
de citoquinas
Actividad fagocítica:
Los fagocitos engullen (fagocitan) partículas extrañas, células
propias lesionadas o muertas y restos celulares.
El fagocito se ve atraído por quimiotaxis, se adhiere por
receptores al microorganismo o partícula extraña, con lo que se activa la
membrana del fagocito, emitiendo pseudópodos (basados en el sistema contráctil
de actina-miosina), que finalmente se fusionan, cerrándose y creándose una
vesícula membranosa que engloba al antígeno, denominada fagosoma.
La destrucción de partícula extraña comienza con la entrada del
fagosoma en la ruta endocítica: el fagosoma se fusiona con los gránulos, para
formar el fagolisosoma.
El contenido vertido de los gránulos, junto con otras actividades
del macrófago, supone una batería de mecanismos microbicidas y
microbiostáticos, además de enzimas hidrolíticas que digieren las
macromoléculas. El material de desecho se elimina por exocitosis.
Clasificación de las actividades antimicrobianas
Mecanismos dependientes de oxígeno:
· Intermediarios
reactivos de oxígeno (ROI)
· Intermediarios
reactivos de nitrógeno (RNI)
Mecanismos independientes de oxígeno: proteínas antimicrobianas
preformadas:
· Péptidos
catiónicos como las defensinas.
· catepsina G
(proteinasa neutra).
· Lisozima.
· lactoferrina
(secuestra Fe y altera las proteínas de FeS.
El macrófago cumple un
papel central en el sistema inmune, participando tanto en la fase de
reconocimiento como en la de presentación del Ag y en la efectora.




 La fagocitosis es la unión del microorganismo a la superficie de una célula fagocitica especializada llamada Fagocito, por algún mecanismo inespecífico. Los gránulos de los fagocitos, originan la destrucción del microbio en unos poco minutos.
La fagocitosis es la unión del microorganismo a la superficie de una célula fagocitica especializada llamada Fagocito, por algún mecanismo inespecífico. Los gránulos de los fagocitos, originan la destrucción del microbio en unos poco minutos.